Analisi di un farmaco: contenuto dell’acido acetilsalicilico nell’aspirina
Farmaco o medicinale è una sostanza in grado di modificare una o più funzioni dell’organismo ed è usato per curare o per prevenire le malattie. È costituito da un principio attivo, componente chimico responsabile dell’attività curativa e dagli eccipienti, sostanze “inerti” che vengono aggiunte al principio attivo per preservarlo da aggressioni esterne, rendendolo più assorbibile da parte dell’organismo mantenendone la stabilità e migliorandone il sapore.
Cosa riporta la confezione di un farmaco?
Le informazioni principali sono:
-Il nome commerciale del medicinale con dei numeri accanto che, per le forme farmaceutiche solide indicano la quantità di principio attivo espressa in unità di peso presente in ogni unità posologica (compressa, supposta, busta…) e per le forme liquide è la quantità di principio attivo espressa in mg/ml presente in ogni ml di soluzione (fiale, gocce,…);
-Il principio attivo;
-La Composizione, cioè la quantità di principio attivo presente e il tipo di eccipienti;
–La forma farmaceutica (compresse, gocce, supposte, fiale ecc);
–La via di somministrazione, cioè come deve essere assunto il medicinale.
L’analisi di un farmaco in laboratorio consiste nell’applicare metodi analitici che permettono di identificare dal punto di vista quali-quantitativo il principio attivo contenuto nel farmaco stesso.
Nel laboratorio di chimica analitica della nostra scuola abbiamo effettuato l’analisi del contenuto di principio attivo nell’Aspirina.
L’Aspirina nome commerciale dell’Acido Acetilsalicilico è un farmaco appartenente alla classe FANS (farmaco antinfiammatorio non steroideo) con effetto antinfiammatorio analgesico e antipiretico, trova infatti impiego nel trattamento di dolori come emicrania, mal di denti, sintomi influenzali e febbrili, ma anche in malattie infiammatorie acute e croniche.
Dal punto di vista chimico l’acido acetilsalicilico è un composto aromatico contenente sia il gruppo acido –COOH che il gruppo estereo – COOR, è un acido debole poco solubile in soluzioni acide, di più in soluzioni alcaline, si presenta come una polvere cristallina bianca.
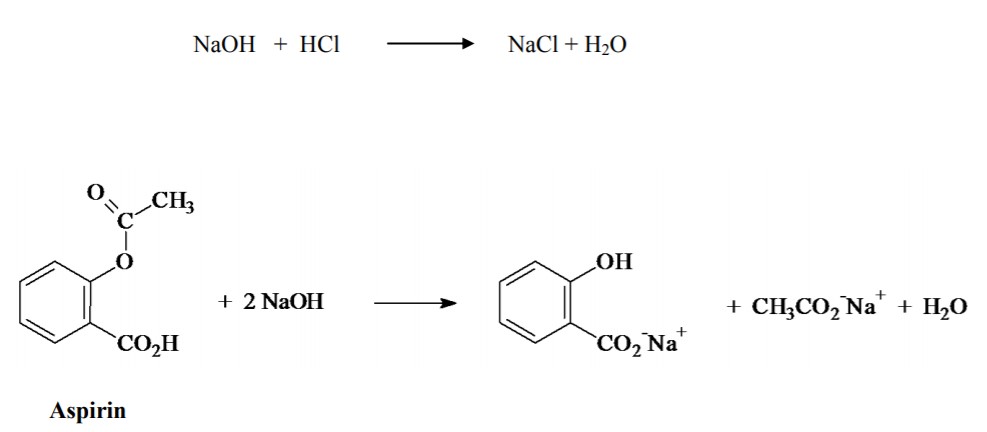
La determinazione della sua concentrazione può essere effettuata in laboratorio tramite una titolazione acido-base, facendo reagire un campione con un eccesso di Idrossido di sodio NaOH (titolante) a caldo e determinando l’NaOH residuo tramite una retrotitolazione.
Dopo aver pesato 12 compresse e aver determinato la massa media di una, sono state polverizzate tramite mortaio e pestello e trasferiti in una beuta 0.2 grammi di polvere. Si è proceduto con l’aggiunta di 30 ml di NaOH 0.1 M e 2 gocce di indicatore fenolftaleina. La colorazione della soluzione è risultata fuxia. Si è riscaldato senza portare all’ebollizione per una decina di minuti per favorire l’idrolisi del gruppo estereo e dopo raffreddamento sotto acqua corrente si è proceduto alla titolazione con HCl 0.1 M (acido cloridrico) fino al viraggio dell’indicatore (la soluzione risulta trasparente).
Di seguito sono riportati la reazione chimica e i calcoli.
Massa di 12 pasticche Aspirina 500= 7,9958 g
Massa media 1 pasticca= 0,6663 g
Massa campione Aspirina = 0,2063 g
Volume di NaOH 0.1 M aggiunto= 30 ml
Volume di HCl 0.1 M consumato nella titolazione= 13,1 ml
mmoli NaOH reagite con acido acetilsalicilico= (0,1mmol/ml·30 ml) – (0,1mmol/ml·13.1 ml) = 1,69 mmol
mmoli acido acetilsalicilico reagite= 1,69:2= 0,845 mmol
massa acido acetilsalicilico reagito= 0,845 mmol·180,16 mg/mmol= 152,235 mg
152,235 mg :0,2063 g = X :0,6663 g
X = Massa di acido acetilsalicilico in una compressa= 492 mg
Sperimentalmente è risultato che una compressa di Aspirina 500 contiene 492 mg di acido acetilsalicilico.
Fabiana Faranda IV B BS