NEUROINFIAMMAZIONE E NEURODEGENERAZIONE: NUOVI APPROCCI TERAPEUTICI
Oggi si sente tanto parlare di neuroinfiammazione e neurodegenerazione, fenomeni tra loro strettamente correlati tanto da poter essere considerati due facce della stessa medaglia.
Ma cosa si intende esattamente con il termine neuroinfiammazione?
Si tratta di un processo infiammatorio “citochina-mediato” che scaturire da un danno tissutale a livello sistemico e, come spesso accade, lo si ritrova associato ad un danno diretto a carico del sistema nervoso centrale, sia esso di natura traumatica che neurodegenerativa. La letteratura scientifica afferma, infatti, che i fenomeni neuroinfiammatori sono presenti sia nelle malattie neurodegenerative, correlate ad alterazioni del movimento quali il Parkinson, ma anche in quelle in cui sono coinvolte importanti alterazioni delle funzioni cerebrali come nel caso della demenza o dell’Alzheimer.
Quali sono le possibili cause che scatenano l’insorgenza di fenomeni neuroinfiammatori e/o neurodegenerativi?
In primo luogo lo stress ossidativo, associato ad un errato stile di vita (fumo, alimentazione, mancanza di esercizio fisico), l’età ed i fenomeni di tipo infiammatorio.
Proprio per tutte le caratteristiche intrinseche che la contraddistinguono la neuroinfiammazione rappresenta il minimo comune denominatore di tutti i processi neurodegenerativi.
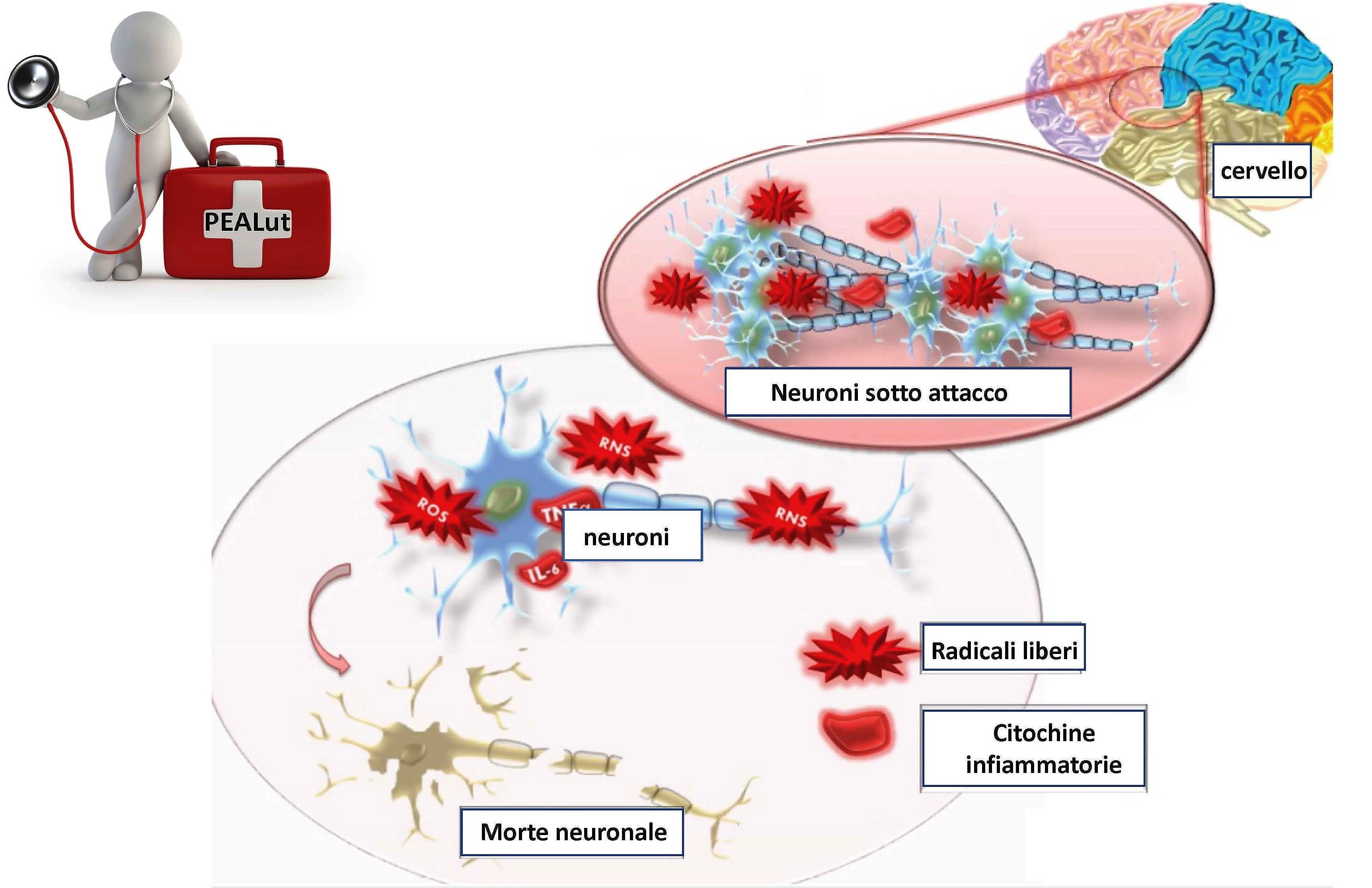
Nello sviluppo dei processi neuroinfiammatori ci sono delle cellule che svolgono un ruolo determinante , definiti i “cellular players”. Sono tre differenti tipi cellulari: microglia, astrociti e mastociti. A livello del sistema nervoso centrale le cellule della microglia svolgono funzioni di immunosorveglianza; se attivate promuovono e sostengono lo stato infiammatorio producendo citochine, intermedi reattivi dell’ossigeno, proteinasi, fattori del complemento e chemochine. I mastociti sono cellule multifunzionali che originano dal midollo osseo; si caratterizzano per la capacità di rilasciare, quando attivati, gli stessi mediatori cellulari che sono rilasciati dalla microglia. Come la microglia, anche gli astrociti, hanno la capacità di rispondere, in condizioni patologiche, mettendo in atto una serie di cambiamenti funzionali e strutturali che prendono il nome di astrogliosi. Gli astrociti sono attivati dalle citochine prodotte dalla microglia e sono in grado, a loro volta, di produrre molecole pro-infiammatorie. Da una parte si ha dunque l’attivazione del mastocita che favorisce il rilascio di citochine proinfiammatorie e fattori neurotrofici, dall’altra la microglia e gli astrociti che favoriscono il rilascio degli stessi mediatori quindi tre giocatori di una stessa partita. Ecco perchè le malattie neurodegenerative e neuroinfiammatorie si devono considerare come due facce della stessa medaglia. La specificità dei processi neuroinfiammatori è quella di scaturire sia al di fuori del sistema nervoso centrale, coinvolgendo poi un recruitment di cellule infiammatorie all’interno del sistema, con conseguente accumulo di linfocifti e mastociti, sia all’ interno dello stesso sistema. A livello periferico, i mastociti rilasciano i loro mediatori infiammatori come le citochine e le prostaglandine, ma analoghe cellule rilasciano gli stessi mediatori anche a livello centrale. L’over espressione di molecole infiammatorie determina così la comparsa di fenomeni tossici e neurodegenerativi, ma acconto al rilascio di molecole proinfiammatorie si ha anche il rilascio di molecole antinfiammatorie in un processo di resolution, atto a bilanciare il processo neuroinfiammatorio.
Quale potrebbe essere l’approccio terapeutico da impiegare per controllare e contrastare il divenire dei processi neuroinfiammatori e/o neurodegenerativi?
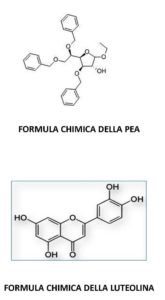
Intuitivamente si potrebbe agire bloccando contemporaneamente l’azione dei tre giocatori cellulari. Questo approccio è quello che è stato impiegato in uno studio traslazionale, condotto dal gruppo di ricerca di Messina, coordinato dal Prof. Salvatore Cuzzocrea, insieme al gruppo di studio del Prof. Carlo Caltagirone, della Fondazione Santa Lucia di Roma, in cui è stata impiegata una nuova formulazione chimica. I risultati di questo studio sono stati pubblicati sulla rivista scientifica internazionale Translational Stroke Research. Nello studio sono stati arruolati 250 pazienti colpiti da ictus, 132 uomini e 118 donne, con un’età media di 71.4 anni, il 62% dei quali mostrava un diffuso danno cerebrale. Nello specifico i soggetti in questione sono stati ospedalizzati per insorgenza di ictus ischemico di primo evento in fase clinica stabilizzata. I pazienti sono stati suddivisi in due gruppi e trattati in maniera randomizzata con terapia farmacologica standard o con la nuova formulazione, ovvero un ultramicrocomposito, costituito dall’unione di due differenti molecole: la palmitoiletanolamide (PEA) e la luteolina.
La PEA è una molecola endogena, ma la si ritrova anche in alimenti quali le uova o la soia; agisce da equilibratore cellulare esplicando il proprio meccanimo d’azione contrastando l’insorgenza di fenomeni neuroinfiammatori attraverso il controllo inibitorio dei mastociti, della microglia e degli astrociti iper attivati. La luteolina è un flavone, lo si ritrova nel carciofo, nel prezzemolo, nel timo o ancora nel sedano e nella propoli. E’ un composto cristallino di colore giallo (dall’aggettivo latino “luteus”) ampiamente utilizzato nella medicina tradizionale cinese per il trattamento di malattie quali l’ipertensione o i disturbi infiammatori.
Cosa succede se due differenti molecole interagiscono formando un solo ultramicrocomposito?
Epitech group, ha immaginato di fondere l’attività antinfiammatoria della PEA con quella antiossidante della luteolina in un solo composto, la PEALut. Farmacologicamente si è ottenuta l’associazione di due molecole con spettri d’azione totalmente differenti ma che divengono complementari e sinergici per cui in grado di contrastare la neuroinfiammazione a favore della neuroprotezione. La formulazione farmacologica che ne deriva è quella dell’ultramicrocomposito PEALut.
Perché combinare due molecole per formare un ultramicrocomposto?
La risposta è tutta nella chimica: le ultramicroparticelle che lo compongono riescono a raggiungere e facilmente oltrepassare la barriera ematoencefalica, raggiungendo nel contempo il sito di iper- attivazione delle cellule non-neuronali verso cui la PEA viene fisiologicamente richiamata. Questa nuova formulazione farmacologica consente dunque alla palmitoiletanolamide di svolgere l’azione di carrier nei riguardi della luteolina verso quelli che sono i focolai di stress ossidativo indotto dalla neuroinfiammazione. La co-ultra PEALut risulta quindi più solubile e più energetica dal momento che i cristalli che la compongono presentano una maggiore energia potenziale che è sprigionata a contatto con i fluidi organici, conferendogli dunque una maggiore velocità diffusionale.
L’ultramicrocomposito PEALut è il principio attivo del Glialia® prodotto che oggi è registrato come alimento a fini medici speciali, somministrato, sotto controllo medico, per il trattamento sintomatico di tutte quelle patologie su base neuroinfiammatoria. Dallo studio è emerso che, dopo 30 giorni dall’inizio del trattamento, i pazienti trattati con la nuova molecola hanno manifestato un miglioramento in tutti i parametri neurologici presi in esame. Dopo 60 giorni è stato riscontrato un recupero dell’attività motoria del 40-50% rispetto a quelle che erano le condizioni di partenza, contro il 20% nei pazienti trattati con terapia standard.
Dallo studio è emerso che questa nuova molecola ha la capacità di far recuperare il 50% della mobilità dopo soli 2 mesi dall’evento. Il Glialia® manifesta una duplice azione in quanto previene il danno neuronale e ritarda l’esordio della patologia o ancora, qualora il danno si sia già verificato come avviene in caso di ictus o trauma cranico, ne rallenta il meccanismo neurodegenerativo.
Dott.ssa Rosalia Crupi