H2O
Un particolare punto di vista.
“Chiare, fresche et dolci acque” declamava Petrarca nel Canzoniere, ispirato, molto probabilmente dal fiume Sorgue che scorre nei pressi del comune francese di Fontaine-de-Vaucluse. Ma cos’è l’acqua, che tanti artisti ha ispirato nei secoli per dipingere o scrivere opere immortali? L’acqua, da un punto di vista chimico, è una piccola molecola, formata solo da un atomo di ossigeno e due atomi di idrogeno. In Chimica ci sono moltissime molecole, anche molto grandi, formate, a volte, da un numero elevatissimo di atomi. Nel caso dell’acqua, il numero esiguo degli atomi che la compongono è inversamente proporzionale all’ importanza che questa molecola assume.
La Terra, non a caso, è definita il Pianeta Azzurro. Il 70% del nostro pianeta è, infatti, ricoperto da acqua. Adesso immaginiamo di avere un microscopio potentissimo ed osservare cosa succede là, nell’infinitamente piccolo. L’ossigeno è un atomo costituito da un nucleo che contiene otto protoni ed è circondato, quindi, da otto elettroni; di cui, due interni, nascosti in un guscio elettronico molto vicino al nucleo, e sei esterni, che rappresentano gli elettroni di valenza; quelli, per capirci, che interagiscono con elettroni di altri atomi. L’Ossigeno, infatti, appartiene al sesto gruppo della Tavola Periodica; ed ha appunto sei elettroni esterni. L’Ossigeno, inoltre, cosa da non trascurare, ha anche una elettronegatività di 3,5. L’elettronegatività è la tendenza che ha un atomo di attrarre a sé gli elettroni di legame. Questo valore di elettronegatività è particolare, insieme alle piccole dimensioni dell’Ossigeno. Solo l’Azoto e il Fluoro, infatti, sono capaci di legarsi con l’Idrogeno come fa l’Ossigeno nell’acqua. Andiamo adesso ad osservare l’Idrogeno. Esso ha un nucleo formato da un solo protone ed intorno ad esso, gira l’unico elettrone che possiede.
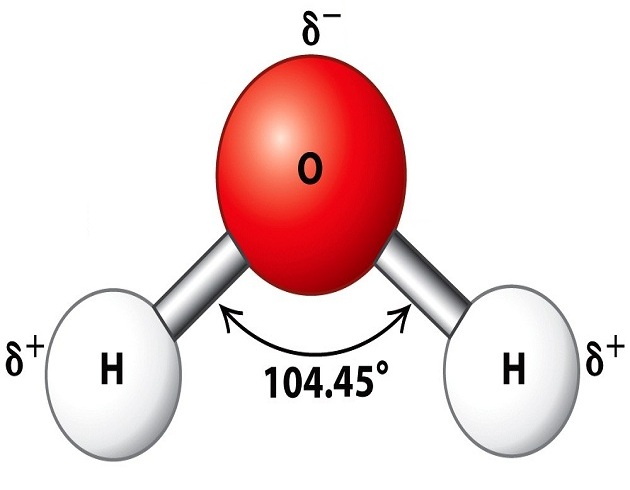
L’Ossigeno ha sei elettroni esterni: gliene mancano due per arrivare a completare il suo ottetto. E così si lega a due atomi di Idrogeno, che possiedono, ciascuno un elettrone. Dovrebbe essere un legame alla pari; una ugual condivisione di una coppia di elettroni; ma l’ossigeno è “egoista” (è, cioè, piuttosto elettronegativo, come abbiamo detto) e, quindi, praticamente, “strappa” l’elettrone al povero Idrogeno, che, quindi, è come se fosse “nudo”. L’Idrogeno viene talmente depauperato della sua carica negativa da diventare un “protone”; una particella che ha una carica positiva di 1,6 x 10-19 Coulomb e pesa 1,67×10-27 Kg. E questo protone “nudo” che fa? Cerca di ritrovare da qualche parte un po’ di “coperta”: un po’ di carica negativa. E, quindi, incomincia ad interagire con l’Ossigeno di una molecola d’acqua vicina; una interazione “debole” e di natura elettrostatica. E quando io penso a questo legame “debole” tra l’idrogeno “nudo” di una molecola d’acqua e l’Ossigeno di un’altra molecola d’acqua, mi viene in mente questa immagine:
Ecco! Se dovessi trovare un’immagine per rappresentare il “legame ad idrogeno”, sarebbe proprio questa: le due mani che si cercano, quasi si raggiungono, ma non si toccano; il legame di natura elettrostatica tra particelle di carica opposta. Il legame a idrogeno è quanto di più maestoso, magnifico e possente esista in Chimica. Nulla ha più importanza di esso. E l’accostamento all’immagine del Giudizio Universale di Michelangelo mi sembra appropriata. Ma perché il legame a idrogeno è così importante? È così importante perché determina il punto di ebollizione dell’acqua. Se non ci fosse il legame ad idrogeno l’acqua bollirebbe a -64°C; il che vuol dire che l’acqua a temperatura ambiente si troverebbe sotto forma di GAS. E poiché noi siamo formati dall’84% di acqua, non ho una immaginazione sufficiente per immaginare come saremmo fatti, o da cosa. La vita, come la conosciamo, certamente non esisterebbe. Nulla di ciò che ci è familiare, esisterebbe. Altro piccolo particolare. Se non bastasse quanto detto. Il “debole” legame a idrogeno è responsabile di un’altra caratteristica dell’acqua: allo stato solido è meno densa. Il che significa che il ghiaccio galleggia sull’acqua. Questo può sembrare insignificante, ma immaginiamo un po’: siamo in Inverno, le temperature si abbassano, si formano gli iceberg ai Poli. Ma cosa succederebbe? Se non ci fosse il legame a idrogeno, tutto il ghiaccio sprofonderebbe nelle acque del mare e il suo livello si innalzerebbe paurosamente. Tutte le zone costiere della Terra sarebbero sommerse periodicamente ad ogni Inverno e non sarebbe possibile la vita in quelle zone. Il “debole” legame ad idrogeno è, quindi, ben lontano dal potersi definire insignificante. Che dire più dell’acqua? L’acqua per noi è tutto; è l’alfa e l’omega (almeno per una persona razionale come me). Lascio ai poeti decantarla. Spero solo che i ragazzi capiscano veramente quanto è preziosa l’acqua e quanto sia importante preservarla: è la vera e sola garanzia della nostra esistenza e della nostra sopravvivenza.
Signorino Graziella





